金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
2022年2月15日,欧盟发布MDCG指南2022-3,关于公告机构对生产的D类IVDs进行验证的要求。

这一指南对制造商很重要,因为它对进入欧盟市场上的D类产品,提供了一份详细说明制造商、公告机构和欧盟参考实验室(EURLs)之间对批次验证的测试计划和协议的要求。
对于D类IVD产品,除了满足质量管理体系和技术文档评估的要求,公告机构还需要按照IVDR的附录IX, XI,对其产品批次进行验证。如果没有成功的批次验证过程,D类产品就不允许进入欧盟市场。
制成品的验证或“批量测试”是用于监测和验证D类IVD产品在CE证书颁发之后的既定性能特征。这种“批测试”对于所有的D类器械都是强制性的,并且需要一个额外的参与者EURL的参与。
批次验证的过程:
1. 委员会指定EURLs,其指定范围将特定于它们已证明具有核查能力的器械,目前,尚未指定EURLs。
根据IVDR联合执行和准备计划,EURL的指定最早将在2023年第一季度。
2. 在符合性评估期间,制造商和NB共同协商确定EURL。
3. 由确定好的EURL作为最初IVDR CE符合性评估过程的一部分,对D类产品进行物理测试,EURL将把调查结果提交给公告机构,最终建立最初的产品规范。
1) 制造商造商将根据之前协定的条件和详细的安排,将D类批次产品邮寄给公告机构,公告机构再请求EURLs进行批次测试。
2) EURL应告知公告机构其测试结论。
3) 公告机构最终负责批次验证过程,并审查EURL发现/报告和制造商QC发放数据/文档。在制造商收到公告机构的通知之前(在收到批次产品的30天之内),不得将D类产品批次投放到欧盟市场。
4.在CE证书颁发之后,EURL验证批次产品性能是否符合最初确定的规范。
此MDCG指南提供了以下几方面的说明:
1. 制造商与公告机构之间协议的细节,包括测试计划、提供样品和其他材料的物流和频率、信息交流等等。
2. 详细说明EURL和公告机构之间的合同要求,以公告机构和制造商之间的协议为基础。
3. 收到来自公告机构的最终批次发放通知的时间表。
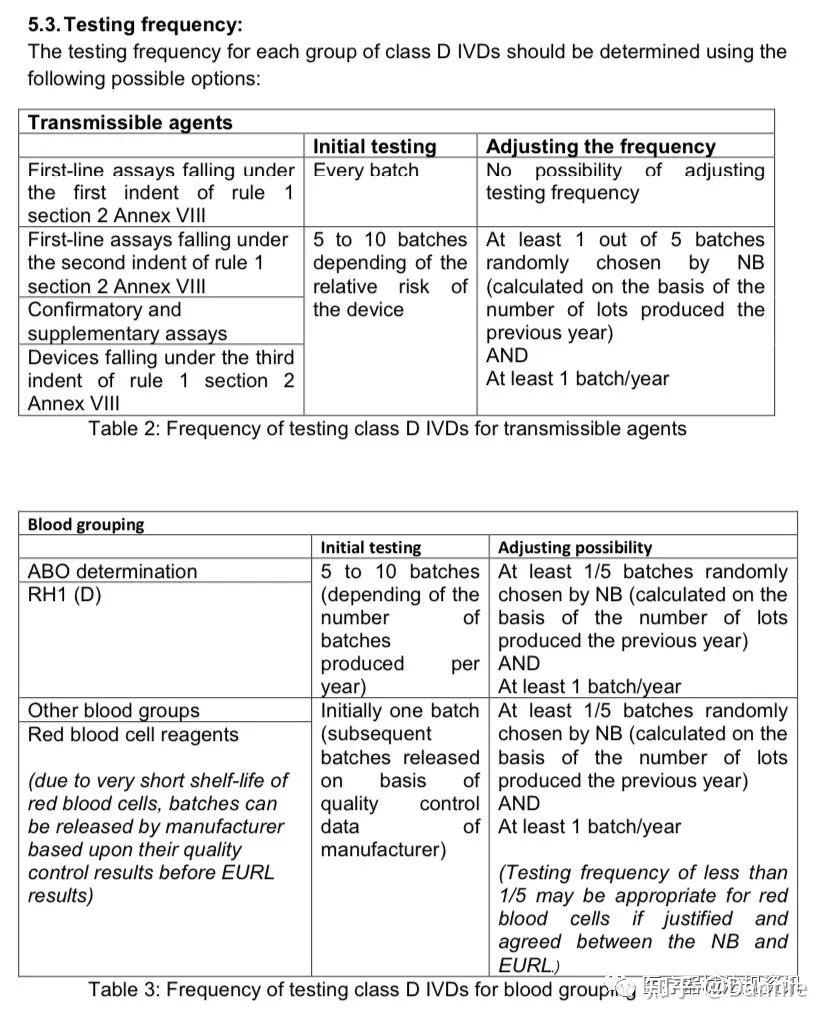
4. 基于风险/影响方法的EURL测试频率和减少测试方案的可能。
注:对于属于rule 1 Annex VIII的第二节第一条,不允许减少测试:用于一线筛查传染源的D类诊断试剂,即,用于“检测血液、血液成分、细胞、组织或器官或其任何衍生物中是否存在或暴露于传染性物质,以评估其是否适合输血、移植或细胞用药”的IVD产品 (detection of the presence of, or exposure to, a transmissible agent in blood, blood components, cells, tissues or organs, or in any of their derivatives, in order to assess their suitability for transfusion, transplantation or cell administration)。也就是说,对于此类传染性物质检测的D类IVD诊断产品,每个批次的产品都需要验证。
在没有EURL的情况下,对于IVDR CE标记的D类器械,如何满足批次发放测试的要求呢?
在没有EURL的情况下,对批次验证需要EURLs参与的要求可以不符合:“In the absence of a designated EURL for a device, the requirements relating to EURLs do not have to be applied”.
此指南规定了公告机构批次验证的最低要求,这包括审查最终QC发放数据和任何相应的文件,例如批记录、最终QC程序。
期待看到公告机构如何应用这个过程,也期待看到第一个D类产品的IVDR证书的颁发。 |
|
 /3
/3 